化学変化と質量・熱(ざっくり)
1.質量保存の法則
・化学変化が起こる前と後で、物質全体の質量は変化しないこと
①沈殿ができる反応
例:うすい硫酸と水酸化ナトリウム水溶液を混ぜると、硫酸バリウムの白色の沈殿ができる
→反応の前後で質量は変化しない
②気体が発生する反応
例:うすい塩酸と炭酸水素ナトリウムを混ぜると、二酸化炭素が発生する
→密閉した容器内では、質量は変化しない
※容器を密閉していないと、質量は減る
理由:発生した二酸化炭素が空気中に出ていくため
③金属の酸化
例:銅を熱すると酸化銅になる
→密閉した容器内では、質量は変化しない
※容器を密閉していないと、質量は増える
→銅と結びついた酸素の分だけ質量が増える
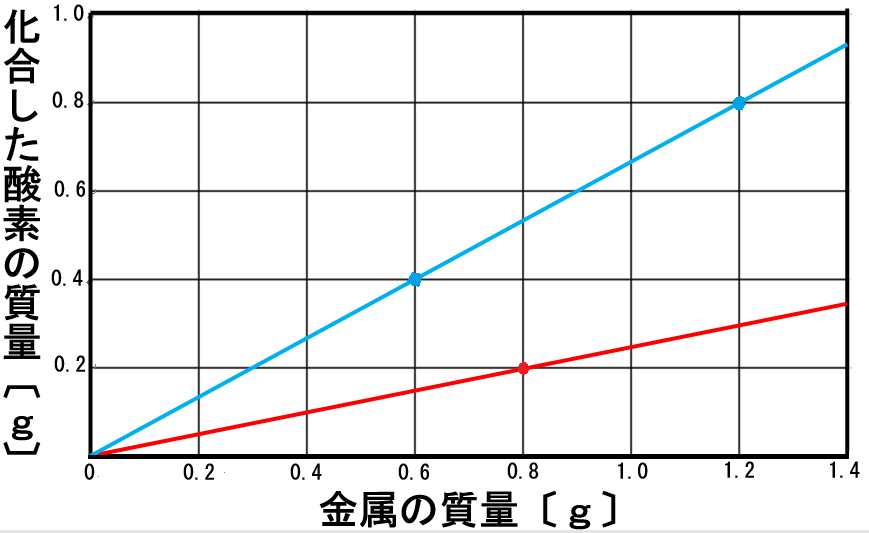
2.化学変化と質量の比
・化学変化が起こる物質の質量比は一定
→グラフに表すと、原点を通る直線になる
※比例のグラフ
①酸化銅の質量比
※グラフの赤い線
・銅:酸素=4:1で化合する
・銅:酸化銅=4:5
・酸素:酸化銅=1:5
例
・銅4gを加熱すると、酸素1gと化合(酸化)して、酸化銅5gができる
・銅8gを加熱すると、酸素2gと化合(酸化)して、酸化銅10gができる
②酸化マグネシウムの質量比
※グラフの青い線
・マグネシウム:酸素=3:2で化合する
・マグネシウム:酸化マグネシウム=3:5
・酸素:酸化マグネシウム=2:5
例
・マグネシウム3gを加熱すると、酸素2gと化合(酸化)して、酸化マグネシウム5gができる
・マグネシウム6gを加熱すると、酸素4gと化合(酸化)して、酸化マグネシウム10gができる
3.化学変化と熱
①発熱反応
・化学変化をするとき、周囲に熱を出す反応(温度が上がる)
例:鉄が酸化して酸化鉄となるとき、熱くなる
→化学かいろに利用(製品名:ホッカイロなど)
②吸熱反応
・化学変化をするとき、周囲の熱をうばう反応(温度が下がる)
例:水酸化バリウムと塩化アンモニウムが反応して、アンモニアが発生するとき
漢字の読み方(タップで開きます)
1.質量保存の法則
・沈殿:ちんでん
・密閉:みっぺい
3.化学変化と熱
・発熱反応:はつねつはんのう
・吸熱反応:きゅうねつはんのう
ざっくり理科2年にもどる