ポイント
すでに学習した水溶液や電気分解の話をよりくわしく学びます。
電気を通す水溶液は、実は陽イオンと陰イオンに分かれていること。
電気分解は、その水溶液中の陽イオン・陰イオンが原子にもどること。
そして、それらのカギをにぎるのは、電子の増減です。
1.原子の構造とイオン
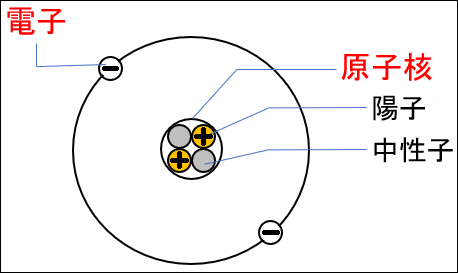
①原子の構造
ⅰ.原子核
・原子の中心にある
・+(プラス)の電気をもっている
※原子核は、陽子(+の電気をもつ)と中性子(電気をもたない)からできている
ⅱ.電子
・原子核のまわりにある
・-(マイナス)の電気をもっている
※原子全体では+と-が打ち消しあい、電気をもたない
②イオン
・電気を帯びた原子のこと
ⅰ.陽イオン
・原子が電子を失い、+の電気を帯びたもの
ⅱ.陰イオン
・原子が電子を受け取り、-の電気を帯びたもの
↓図:イオンのでき方
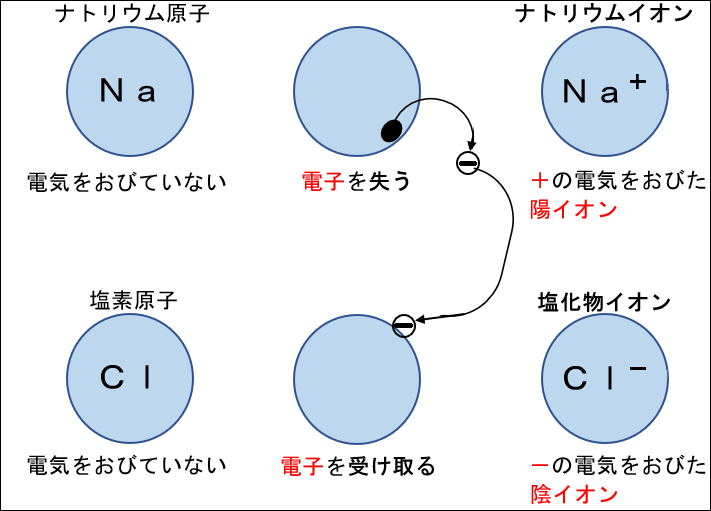 ※原子によって、陽イオンになるもの、陰イオンになるもの、失う電子の数、受け取る電子の数は決まっている
※原子によって、陽イオンになるもの、陰イオンになるもの、失う電子の数、受け取る電子の数は決まっている
③イオンの例
ⅰ.陽イオン
a.水素イオン
・水素原子が電子を1個失い、+の電気を帯びたもの
・イオン式:H+
ⅱ.銅イオン
・銅原子が電子を2個失い、+の電気を帯びたもの
・イオン式:Cu2+
ⅱ.陰イオン
a.水酸化物イオン
・酸素原子と水素原子が結合した状態で電子を1個受け取り、-の電気を帯びたもの
・イオン式:OH-
b.塩化物イオン
※「塩素イオン」とは言わないので注意
・塩素原子が電子を1個受け取り、-の電気を帯びたもの
・イオン式:Cl-
c.硫酸イオン
・硫黄原子1個と酸素原子4個が結合した状態で電子を2個受け取り、-の電気を帯びたもの
・イオン式:SO42-
2.水溶液とイオン
①電解質
・水に溶けるとイオンになり、電流が流れる物質
(電離する物質)
例:塩化ナトリウム(食塩)、塩化水素、水酸化ナトリウムなど
・電離…電解質が水に溶けて、陽イオンと陰イオンに分かれること
② 電離の例と電離式
ⅰ.塩化ナトリウム水溶液(食塩水)
・電離式:NaCl → Na+ + Cl-
・意味:電解質の塩化ナトリウム(食塩)は、水に溶けて電離し、ナトリウムイオンNa+と塩化物イオンCl-に分離した
(塩化ナトリウム水溶液には、Na+とCl–がふくまれている)
ⅱ.水酸化ナトリウム水溶液
・電離式:NaOH → Na+ + OH-
・意味:電解質の水酸化ナトリウムは、水に溶けて電離し、ナトリウムイオンNa+と水酸化物イオンOH-に分離した
(水酸化ナトリウム水溶液には、Na+とOH–がふくまれている)
ⅲ.塩酸
・電離式:HCl → H+ + Cl-
・意味:電解質の塩化水素は、水に溶けて電離し、水素イオンH+と塩化物イオンCl-に分離した
(塩酸(塩化水素水溶液)には、H+とCl–がふくまれている)
※塩酸は、塩化水素が水に溶けたもの(塩化水素の水溶液)
③非電解質
・水に溶けても電離せず(イオンにならず)、電流が流れない物質
例:砂糖、エタノールなど
3.電気分解とイオン
①電気分解のしくみ
ⅰ.これまでに習った内容
・塩酸の電気分解の化学反応式は
2HCl → H2 + Cl2
ⅱ.電気分解で実際に起こっていること
↓図:塩酸の電気分解と電子・イオン
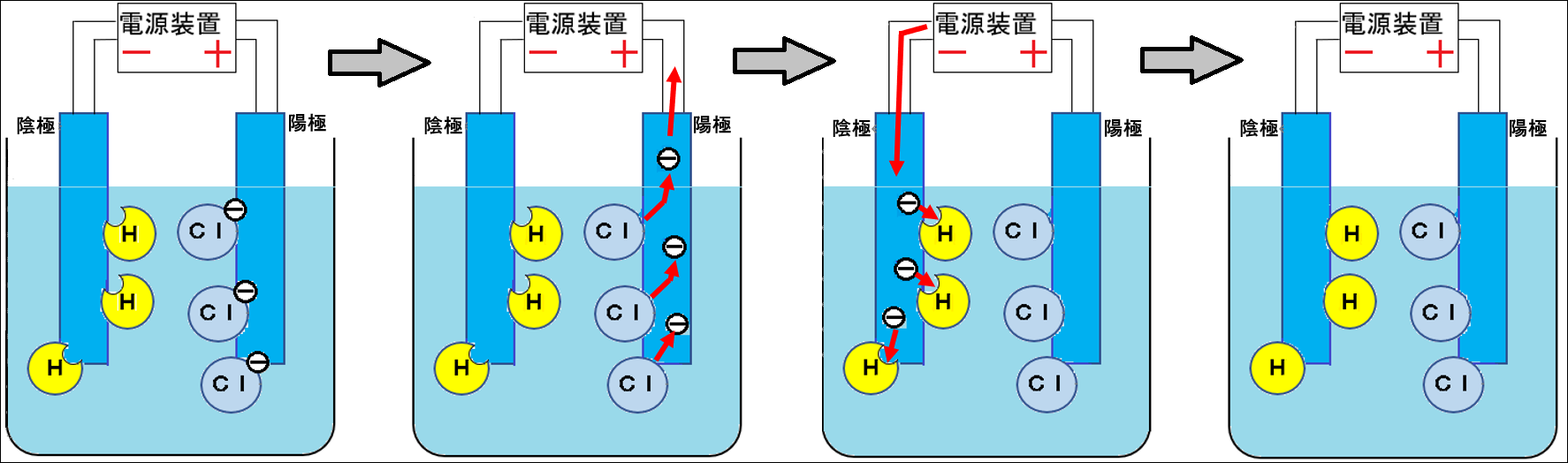
上の図の解説
・塩酸は電解質なので、水溶液中では陽イオンの水素イオンH+と、陰イオンの塩化物イオンCl-に分かれている
・電気分解を始めると、陰イオンは陽極(+極)に、陽イオンは陰極(-極)に引き寄せられる
・陰イオンの塩化物イオンCl-は電子を失い(陽極に電子をわたす)、塩素原子Clになる
・陽イオンの水素イオンH+は電子を受け取り(陰極から電子を受け取る)、水素原子Hになる
・塩素原子は2個結びついて、塩素分子Cl2になる
・水素原子は2個結びついて、水素分子H2になる
4.電池(化学電池)
・化学変化によって、物質の化学エネルギーを電気エネルギーに変えて取り出す装置
①電池のしくみ
・電解質の水溶液の中に2種類の金属板を電極として入れ、導線でつなぐと電流が流れる
②電池の例
・塩酸に、亜鉛板と銅板を入れて導線でつなぐ
→亜鉛板が-極、銅板が+極になる
・電子は亜鉛板から銅板に移動する(電流の発生)
漢字などの読み方(タップで開きます)
1.原子の構造とイオン
・原子核:げんしかく
・陽子:ようし
・中性子ちゅうせいし
・陽イオン:ようイオン
・陰イオン:いんイオン
・H+:エイチプラス
・Cu2+:シーユーにプラス
・OH-:オーエイチマイナス塩化物:えんかぶつ
・Cl-:シーエルマイナス
・SO42-:エスオーフォーにマイナス
2.水溶液とイオン
・電解質:でんかいしつ
・電離:でんり
ざっくり理科3年にもどる