0.水溶液と酸性・中性・アルカリ性
①pH
・水溶液の性質(酸性・中性・アルカリ性)を表す数値
※0~14の数値をとる
・0~6が酸性:0に近づくほど強い酸性
・7が中性
・8~14がアルカリ性:14に近づくほど強いアルカリ性
②水溶液の例
ⅰ.酸性
・塩酸、硫酸、酢
ⅱ.中性
・食塩水、砂糖水
ⅲ.アルカリ性
・水酸化ナトリウム水溶液
③リトマス紙の変化
ⅰ.酸性
・青色を赤色に変える
ⅱ.中性
・変化なし
ⅲ.アルカリ性
・赤色を青色に変える
④BTB溶液
ⅰ.酸性
・黄色
ⅱ.中性
・緑色
ⅲ.アルカリ性
・青色
⑤フェノールフタレイン溶液
ⅰ.酸性
・無色透明のまま
ⅱ.中性
・無色透明のまま
ⅲ.アルカリ性
・赤色になる
1.酸
・水溶液にしたとき水素イオン(H+)を生じる化合物
例:塩酸(塩化水素)(HCl → H+ + Cl-)
・水溶液は酸性を示す
・青色リトマス紙を赤色に変える
2.アルカリ
・水溶液にしたとき水酸化物イオン(OH-)を生じる化合物
例:水酸化ナトリウム(NaOH → Na+ + OH-)
・水溶液はアルカリ性を示す
・赤色リトマス紙を青色に変える
3.中和
・酸とアルカリがたがいの性質を打ち消しあう反応
・酸性の水溶液とアルカリ性の水溶液を混ぜると起こる
→水と塩ができる
①水
・酸の水素イオンとアルカリの水酸化物イオンが結びついてできる
・イオンの式で表すと、H+ + OH- → H2O
②塩
・酸の陰イオンと、アルカリの陽イオンが結びついてできる
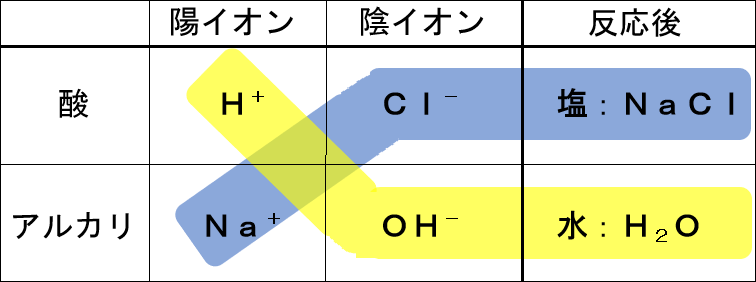
3’.中和の例
・塩酸(塩化水素の水溶液)と水酸化ナトリウム水溶液を混ぜた場合
①酸
塩酸(HCl)
・陽イオン:H+
・陰イオン:Cl-
②アルカリ
水酸化ナトリウム(NaOH)
・陽イオン:Na+
・陰イオン:OH-
③:①と②を混ぜると反応が起こる
ⅰ.水ができる反応
・ H+ + OH- → H2O
ⅱ.塩ができる反応
・ Na+ + Cl- → NaCl
ⅲ.結果
・塩酸と水酸化ナトリウム水溶液を混ぜ合わせると、水と塩(塩化ナトリウム)ができる
※中和では必ず水ができるが、塩は混ぜ合わせる物質によって異なる
→塩酸と水酸化ナトリウムの場合は、塩として塩化ナトリウムができる
※この反応を2年生で学習した化学反応式で表すと
HCl + NaOH → NaCl + H2O
となる
※その他の中和の例
・うすい硫酸(H2SO4)に水溶液バリウム(Ba(OH)2)を加えたとき、
水:H2O
塩:硫酸バリウム(BaSO4)
ができる
漢字などの読み方(タップで開きます)
0.水溶液と酸性・中性・アルカリ性
・pH:ピーエイチ
3.中和
・塩:えん
ざっくり理科3年にもどる